《威士忌生产工艺与营销策略(第二版)》第七章
第7章:酿造酵母与发酵
Inge Russell
摘要
对于任何成功的蒸馏厂而言,选择合适的酵母至关重要。尽管蒸馏酵母与酿造酵母有许多相似特征,但在工艺上也存在重要差异,这些差异直接影响酵母在蒸馏厂中的使用方式。了解酵母细胞的结构及其代谢途径,对于酵母在营养吸收、温度控制、活力/活性、培养、储存和接种方面的管理具有重要启示。蒸馏酵母成功发酵的目标是将原料持续代谢为酒精和许多其他理想的发酵产物,以生产发酵产品,经蒸馏后形成具有令人满意风味和品质的威士忌。
关键词
风味化合物 代谢途径 营养 结构 酵母
引言
对于任何蒸馏厂而言,选择合适的酵母都至关重要。传统上,人们很少考虑这种选择,威士忌发酵通常使用本地采购的酿造废酵母。这种酵母通常在蒸馏厂附近可获得,且价格低廉、获取和使用方便。然而,多年来,对乙醇耐受性更好、底物范围更广的专用蒸馏酵母已变得更受欢迎,可替代酿造废酵母,有时(不常见)会与酿造酵母混合使用(Stewart 等人,2013)。如今,纯培养蒸馏酵母已可商业化获得。许多纯培养蒸馏酵母具有额外的遗传组成,使其能够发酵更大的糖分子(如麦芽四糖,G4)和较小的糊精分子(G5 及更大分子),并且还能更好地承受发酵压力(细节见后文)。
对蒸馏商而言,酵母的重要特征包括以下几点:酒精生产能力、渗透压、糖、温度和 pH 耐受性、适当的絮凝特性,以及在接种前储存期间增强的生存能力和活力。此外,菌株的发酵速度、首次接种时的发酵滞后期,以及针对特定蒸馏产品的 congeners(代谢物)的正确形成(Stewart 和 Russell,2009)都是关键特征。
苏格兰和其他威士忌生产商(与啤酒酿造商不同)不回收酵母,且相关法规也不允许向糖化液或发酵液中添加酵母营养物或酶等营养素,这使得为合适的底物选择正确的酵母菌株变得更加重要。然而,中性烈酒生产有不同的法规,允许进行这些添加。理论转化效率超过 90% 的最终乙醇收率是目标。
酵母来源
初级酵母可在酿酒厂中从其自身的起始培养物中扩培,或由商业酵母生产公司以多种形式供应,如干酵母、湿饼状酵母或稳定的液体酵母。这些酵母的组成如下:干酵母(约95%干重)、压榨酵母(约26%干重)或奶油状酵母(约18%干重)。酵母通常通过需氧方式扩培。可混合次级酵母(传统上为酿酒厂的废啤酒酵母)以增加风味,在某些情况下,这种添加可导致最终乙醇产量更高。
优质蒸馏酵母有许多供应商,由于供应和质量问题,以及因酵母接种物质量变化而难以保持一致风味特征的问题,废啤酒酵母的使用已逐步淘汰。与特定产品相关的风味一致性是一个重要因素,因为所选择的酵母会影响烈酒的风味。后者的酵母特性尚未被完全理解(Noguchi 等人,2008)。多年来,人们一直认为蒸馏酵母的唯一功能是生成乙醇,但事实并非如此!
蒸馏厂对所购买的酵母有标准的微生物质量标准。这些标准包括高存活率(>95%)和可接受的细菌及野生酵母水平(每克总菌数<1×10⁴)。每克干酵母中的污染细菌应<1×10³个醋酸杆菌、乳酸菌和/或片球菌,且不存在致病微生物。
发酵的快速启动对于避免细菌污染至关重要。一些酵母菌株的基因组成中包含“杀手因子”,可帮助保护发酵免受某些野生酵母菌株的污染。然而,杀手因子更常用于葡萄酒酵母(Van Vuuren 和 Jacobs,1992)。
酵母命名法
用于传统发酵的酵母命名是一个容易引起混淆的主题,文献中的表述也不统一。传统上,面包酵母是酿酒酵母(Saccharomyces cerevisiae),大多数威士忌酵母菌株也是酿酒酵母,尽管有时会将其他酵母物种与该特定酵母物种结合使用。
啤酒厂的拉格酵母(正确名称为巴氏酵母Saccharomyces pastorianus,而非酿酒师仍常用的旧名称卡尔斯伯酵母S. carlsbergensis)在高于34°C的温度下无法生长。由于拉格酵母偏好较低的生长温度,这使其非常适合用于拉格啤酒生产的发酵温度,该温度(8至18°C)始终低于艾尔啤酒的发酵温度(20至26°C)。
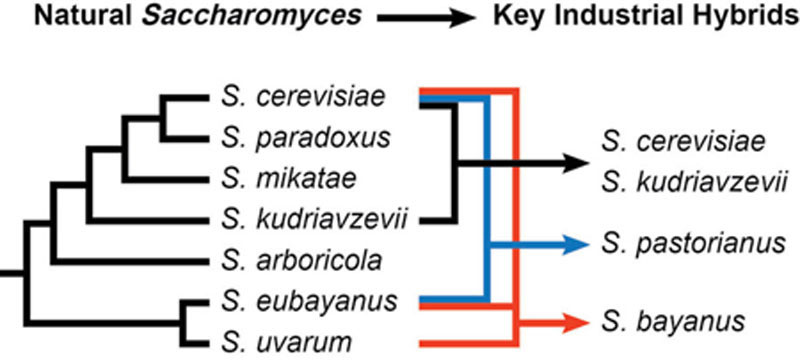
巴氏酵母(Saccharomyces pastorianus)是艾尔酵母酿酒酵母(S. cerevisiae)与另一种酵母——真贝酵母(S. eubayanus)的杂交种。对发酵环境中发现的另一种酵母贝酵母(S. bayanus)的测序研究表明,它是真贝酵母、葡萄汁酵母(S. uvarum)和酿酒酵母的复杂杂交种(Hittinger,2013)。
在工业生产中,面包酵母通常是酿酒酵母,拉格酵母是巴氏酵母,艾尔酵母包括酿酒酵母,很少使用贝酵母菌株,朗姆酒主要用酿酒酵母和粟酒裂殖酵母(Schizosaccharomyces pombe)发酵(还有各种野生酵母)。葡萄酒行业主要使用酿酒酵母和/或贝酵母,以及在葡萄上自然发现的各种野生酵母,如克勒克酵母(Kloeckera)、拟酵母菌(Saccharomycodes)、裂殖酵母(Schizosaccharomyces)、汉逊酵母(Hansenula)、假丝酵母(Candida)、毕赤酵母(Pichia)和球拟酵母(Torulopsis)。
目前已确认的酿酒酵母属(Saccharomyces)的天然物种包括酿酒酵母(S. cerevisiae)、奇异酵母(S. paradoxus)、米基塔酵母(S. mikitae)、库德里亚夫采夫酵母(S. kudriavzevii)、树生酵母(S. aboricola)、贝酵母(S. bayanus)和卡里奥卡酵母(S. cariocanus)(Naumov等人,2013)。这些物种的各种组合产生了图7.1所示的工业杂交种。这些不同的物种可进一步分为不同的菌株,目前酿酒酵母有数千种不同的菌株。在酒精生产中使用的驯化酵母之间,杂交现象很常见。随着分类学领域现有先进分子技术的应用,解析这些菌株的复杂历史仍在不断发展(Walther等人,2014)。
酿酒酵母(Saccharomyces cerevisiae)是一种研究得极为透彻的生物,因为科学家们将其用作模型来探索真核生物系统。真核细胞包括动物、真菌和植物细胞,而原核细胞包括细菌和蓝细菌(蓝绿藻)。1996年,酿酒酵母(单倍体菌株S288c)成为首个完成全基因测序的真核生物基因组(Goffeau等人,1996),如今在酿酒酵母中已鉴定出6000多个蛋白质编码基因。有许多数据库包含了关于这种酵母基因和蛋白质的大量信息。酿酒酵母基因组数据库(SGD)位于http://www.yeastgenome.org/ ;该网站提供有关酵母的信息,并拥有搜索和分析工具,使研究人员能够探索这些数据。甚至还有一款iPhone应用程序,帮助研究人员方便地浏览庞大的酿酒酵母数据库,以跟踪感兴趣基因的研究进展(Wong等人,2013)。
理解酵母细胞的结构
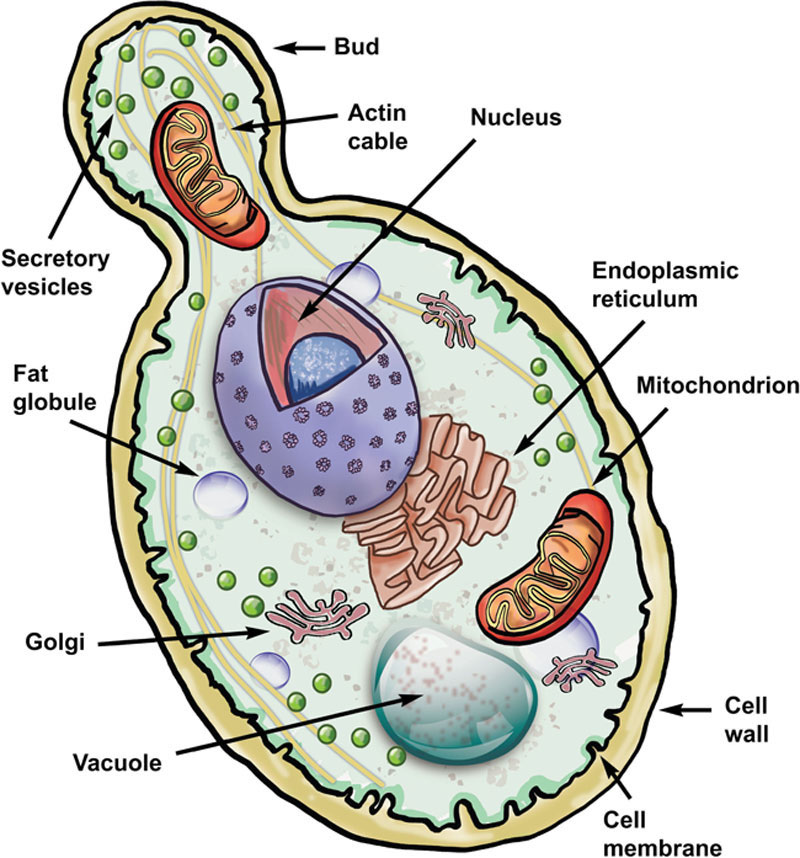
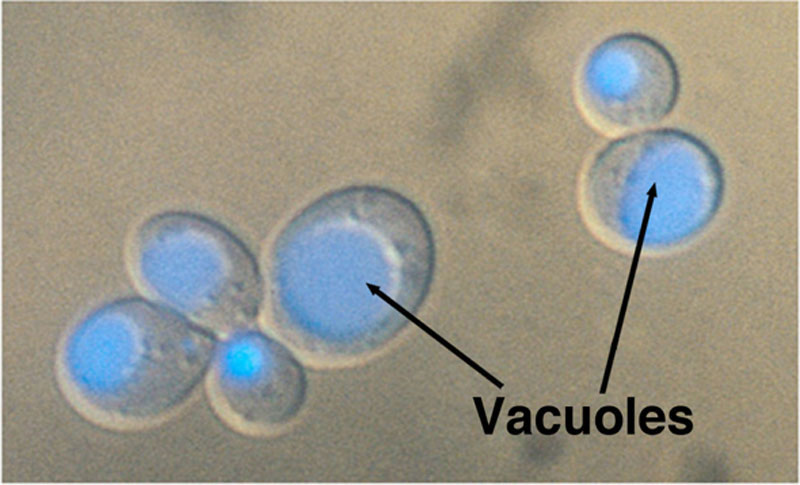
包括酿酒酵母属(Saccharomyces)在内的酵母是单细胞真菌。典型的酿酒酵母细胞大小各异,直径约为5至10微米(1微米=10⁻⁴厘米)。图7.2为酵母细胞的示意图,展示了细胞的主要结构特征。单个细胞肉眼不可见,必须在光学显微镜下观察。对于未染色的细胞,除了细胞质中较大的液泡外,很难看到细胞内的任何细节(图7.3)。
细胞壁
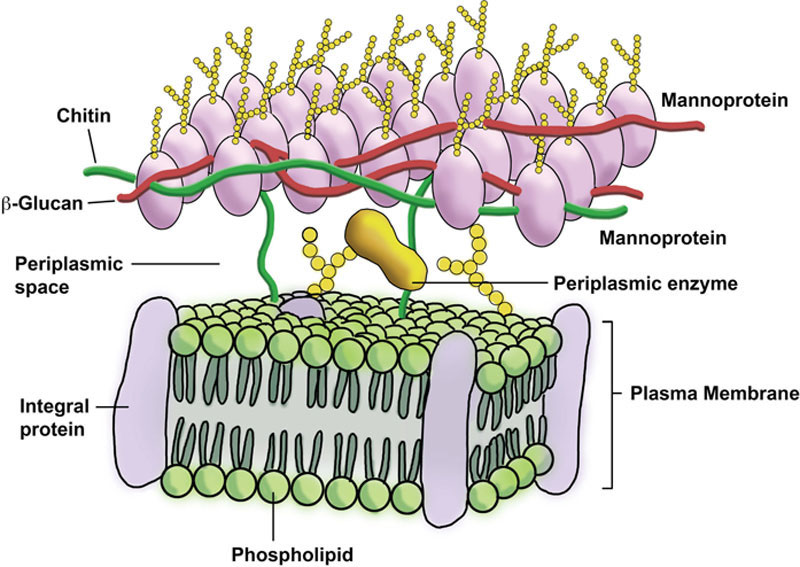
酵母细胞壁是一种刚性结构,除了其他功能(如渗透稳态、细胞形态维持和蛋白质支架功能)外,还为细胞提供物理保护,尤其是抵御“外界环境”的压力。细胞壁主要由葡聚糖、甘露糖蛋白(以前称为甘露聚糖)和几丁质组成(图7.4)。这三种化合物占细胞壁的90%以上。细胞壁占细胞干重的10%至25%,其中甘露糖蛋白部分占壁的30%至50%,β-葡聚糖占35%至55%,几丁质占1.5%至6%。根据环境的不同,细胞壁厚度在约100至200纳米之间变化,当细胞进入生长周期的稳定期时会增厚。
酵母质膜
尽管细胞壁决定了酵母细胞的整体形状,但质膜是细胞存活的关键。酵母质膜是外界与细胞内部之间的屏障。它是一层仅7纳米厚的脂质双层,其中嵌入或贯穿了多种蛋白质(如糖蛋白),所有这些蛋白质都具有多种功能(图7.4)。质膜具有选择透过性,允许气体和水进出细胞,同时控制许多其他分子(如碳水化合物、氮、离子和代谢物)的通过。
周质空间
周质空间是细胞壁和质膜之间的区域。无法穿透细胞壁的分泌蛋白(甘露糖蛋白)位于此处。这些蛋白质履行重要功能,例如水解蔗糖和蜜二糖的酶。这些糖无法穿过质膜进入细胞。位于周质空间的转化酶将蔗糖转化为葡萄糖和果糖,这两种单糖随后可以通过质膜进入细胞。
细胞核
细胞核是包含细胞大部分(超过98%)脱氧核糖核酸(DNA)的结构。细胞的DNA排列成16条染色体,包含6000多个基因,这些基因编码了细胞中合成的大部分蛋白质。核的双层膜上间隔分布着核孔,酵母细胞核在整个细胞周期中保持完整。对细胞分裂重要的纺锤体(SPBs)位于相对的两极。
线粒体
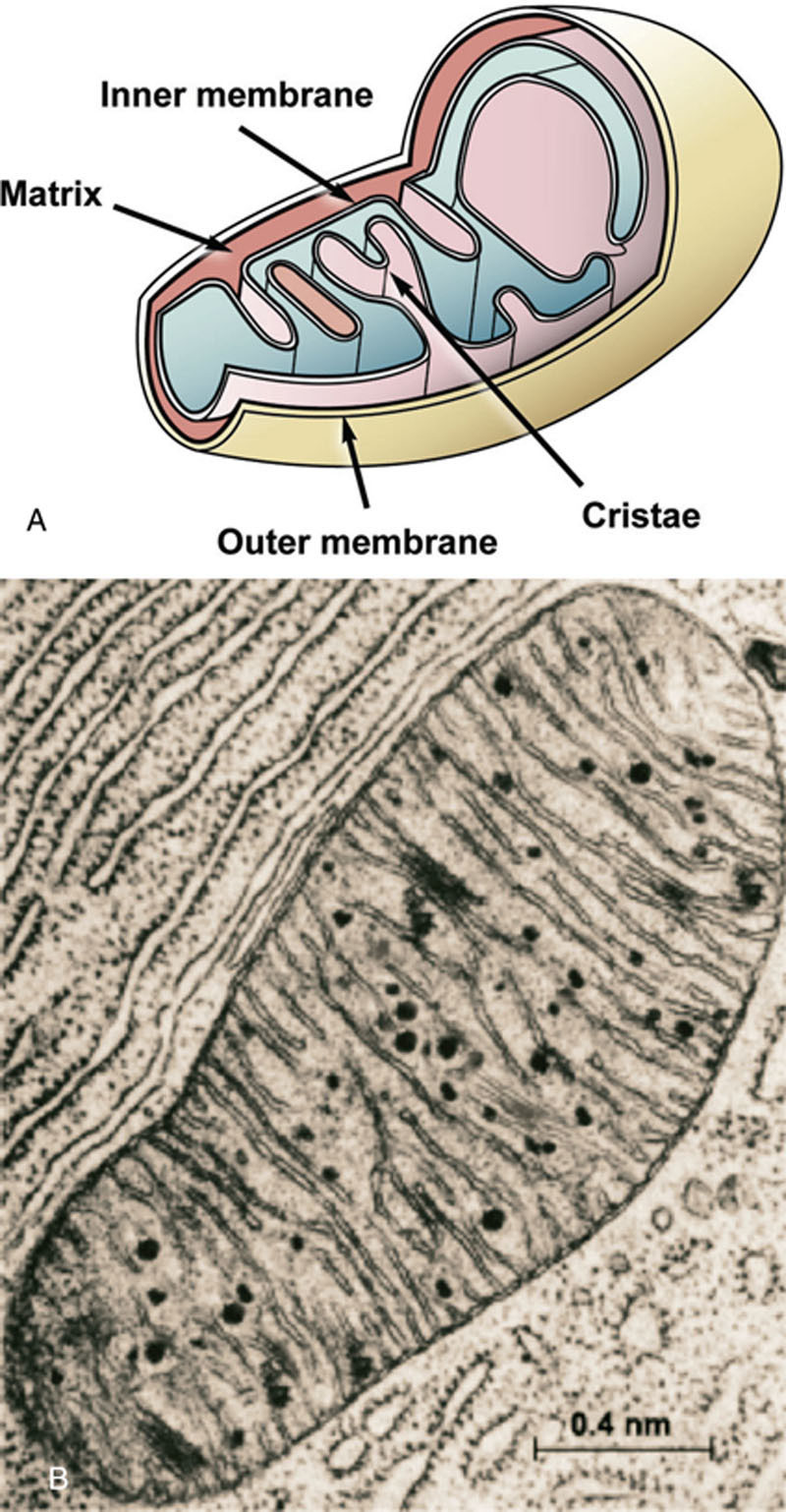
线粒体(图7.5)包含需氧呼吸过程中所需反应的酶。在有氧条件下(存在氧气时),酵母线粒体参与三磷酸腺苷(ATP)的合成(氧化磷酸化)。在有氧生长的酵母细胞的电子显微镜图像中,线粒体易于识别为球形或杆状(香肠状)结构,被双层膜包围。它们包含由内膜折叠形成的嵴。三羧酸循环(TCA)的大多数酶存在于线粒体基质中。参与电子传递和氧化磷酸化的酶与内膜嵴相关。在缺乏脂质的厌氧条件下生长的细胞具有非常简单的线粒体,由外双层膜组成,但缺乏嵴。线粒体拥有自己的DNA(mtDNA),其含量不到细胞总DNA的2%。
细胞质及其成分
细胞质是线粒体所在的位置,也是发生呼吸相关反应的场所。细胞质还包含一个称为内质网(ER)的膜系统,其中一些膜与核糖体(蛋白质合成的场所)相关联。内质网是合成和修饰将要输出到细胞质中的蛋白质的场所。蛋白质从内质网通过囊泡被引导至高尔基体,从高尔基体输送的蛋白质通过不同的分泌囊泡被引导至细胞内的不同位置或细胞外。
细胞质中最大的细胞器是液泡。液泡是一种动态结构,可以迅速改变其形态。液泡主要是碱性氨基酸、多磷酸盐、某些金属离子(Ca²⁺、Zn²⁺、Mg²⁺、Mn²⁺)和特定酶(包括多种蛋白酶)的储存区室。它们是酵母中参与蛋白质细胞内运输和渗透调节的关键细胞器。在光学显微镜下,可以在酵母的细胞质中看到可能变得相当大的液泡(图7.6)。
液泡空间被称为液泡膜的液泡膜包围。该膜包含特定的膜结合蛋白和几种通透酶。液泡膜在与液泡相关的代谢过程中起重要作用。
酵母的繁殖:芽痕和出生痕
酿酒酵母细胞生长群体的一个显著特征是存在出芽的酵母细胞。子细胞从一个小芽开始,在整个细胞周期中不断增大,直到几乎与母细胞大小相同,此时它与母细胞分离。细胞分离的位置在母细胞上留下芽痕,在子细胞上留下出生痕(图7.7)。这些疤痕可以用荧光染料(如钙荧光白)染色,然后使用荧光显微镜观察和计数。没有两个芽在酵母细胞壁的同一位置出现,每次产生芽时,母细胞的细胞壁上就会形成一个新的芽痕。计算芽痕的数量可以用来确定细胞的年龄(即它出芽的次数)。
酵母细胞的生物化学及其从麦芽汁中摄取营养物质
当酵母首次接种到麦芽汁中时,它被引入到一个由单糖、糊精、氨基酸、肽、蛋白质、维生素和矿物质以及许多其他成分组成的非常复杂的环境中。如果没有正确的营养成分以及合适的温度和pH值,酵母将难以生长。
碳水化合物代谢途径
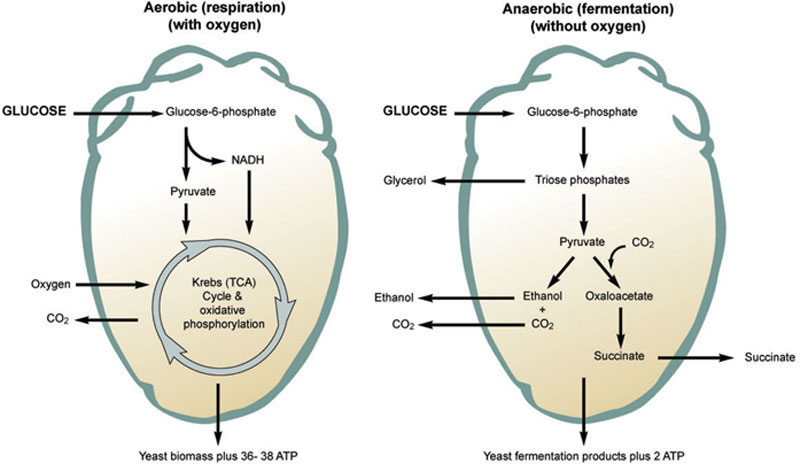
酿酒酵母细胞将碳水化合物(尤其是葡萄糖)作为其主要能量来源。糖酵解途径(厌氧)将葡萄糖转化为丙酮酸,产生ATP形式的能量,然后与中间产物的形成和NADH形式的还原力偶联,用于细胞的各种生物合成途径。酵母是唯一能够高效地在需氧(呼吸)途径和厌氧(发酵)途径之间来回切换的微生物。这两种途径如图7.8所示。
一旦葡萄糖进入细胞,它会通过所谓的糖酵解途径或Embden–Myerhof–Parnas(EMP)途径转化为丙酮酸(图7.9)。
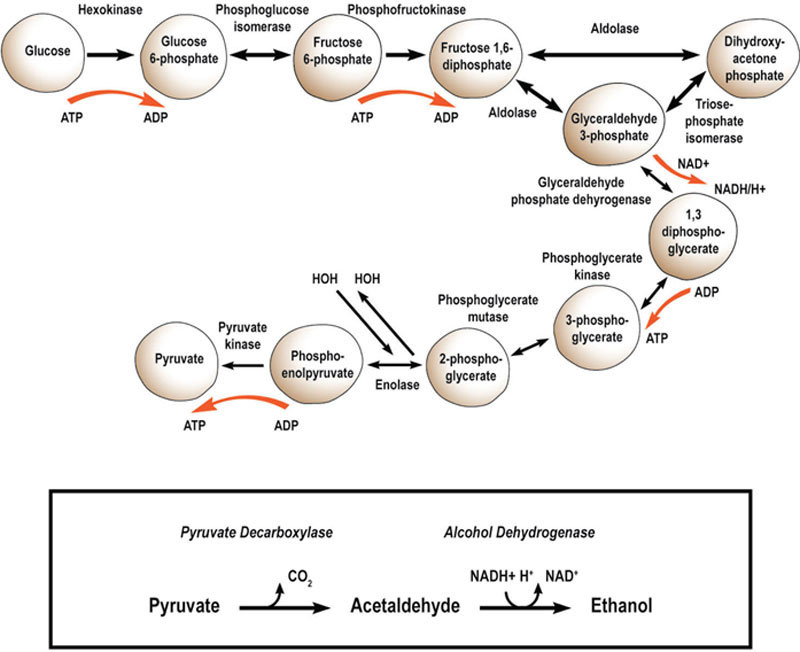
葡萄糖发酵为乙醇的总方程式如下:
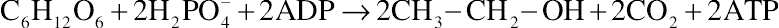
酵母使用的另一种替代途径是戊糖磷酸循环。该循环发生在细胞质中,为细胞提供戊糖(5碳糖)和细胞质NADPH,这些是合成核酸和某些氨基酸的生物合成反应所必需的。
有氧条件下酵母细胞内发生了什么?
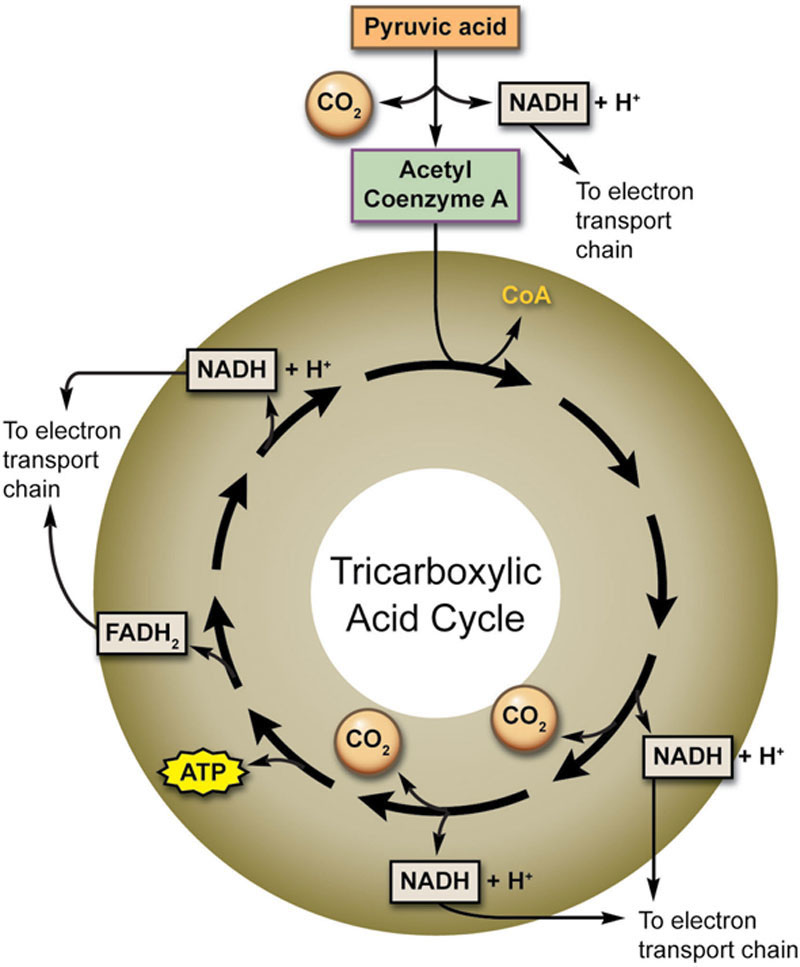
由于存在众多代谢途径且同一途径往往有不同名称,各种酵母代谢循环可能会让人感到十分困惑!在有氧条件下(存在氧气时),除了氧化磷酸化(也称为电子传递链)外,还会发生一系列关键反应,称为三羧酸(TCA)循环或克雷布斯循环(以该途径的主要发现者汉斯·克雷布斯命名)。
TCA循环始于丙酮酸——丙酮酸是糖酵解的终产物,也是所有类型细胞呼吸(及生物合成反应)的第一步。TCA循环发生在线粒体基质中,利用NAD+和FAD的反应将高能电子携带至线粒体内膜的电子传递系统。这些反应通过化学渗透(离子穿过选择透过性膜、沿其电化学梯度移动的过程)负责产生大部分ATP。质子泵建立质子梯度,质子的能量利用二磷酸腺苷(ADP)和磷酸离子作为起始原料生成ATP。
由于TCA循环反应、电子传递系统和化学渗透的作用,细胞呼吸过程中每分子葡萄糖可产生36分子ATP。此外,糖酵解过程还会产生2分子ATP,因此总共生成38分子ATP。TCA循环的简化示意图如图7.10所示。
酵母与氮代谢
总体而言,酵母的营养需求相对简单;然而,它们确实需要氮源来生长,并且对某些含氮化合物的吸收具有高度选择性(图7.11)。酵母能够利用多种含氮化合物,包括氨、尿素和多种氨基酸。小肽可被酵母细胞吸收,进入细胞后可被切割成氨基酸。
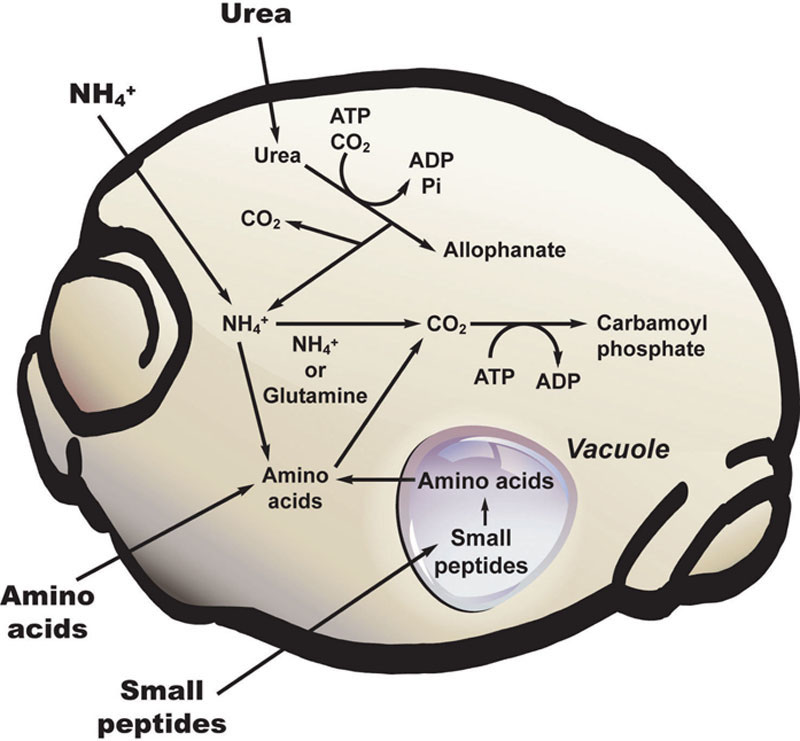
在威士忌发酵中,与啤酒发酵类似,氮的主要来源是麦芽大麦在制麦和糖化过程中蛋白质水解产生的氨基酸、小肽和铵离子(Lekkas等人,2014)。酵母需要这些氮作为营养物质,以合成蛋白质、RNA、DNA和其他化合物。酿酒酵母能够从这些氮源中合成其所需含氮大分子的所有结构单元。在全麦芽麦汁中,氨基酸通常不会成为限制因素,但在谷物麦汁中可能会成为限制因素。
当培养基中存在优质氮源(如谷氨酸和天冬氨酸)时,某些参与吸收和利用劣质氮源(如氨和色氨酸)的基因转录会被抑制(这称为氮分解代谢物阻遏)。这限制了酵母在存在优选氮源时利用劣质氮源的能力。酵母还具有氮感知和信号传导机制,涉及两种不同的传感器:细胞表面氨基酸传感器(与氨基酸通透酶相关)和细胞质氮传感器。
为了使氮源被酵母吸收,它们必须能够穿过质膜,而质膜对这些化合物不渗透,需要嵌入膜中的特定蛋白质协助运输。这些蛋白质(通透酶)受到高度调控,关于氮代谢途径的运作仍有许多尚未完全了解的部分。三种通透酶负责将铵离子导入酵母细胞,且这些通透酶会受到培养基中其他氮源的阻遏。
氨基酸被酵母细胞吸收并用作蛋白质的构建单元。存在一组氨基酸通透酶,可实现运输和调控。酵母有能力从简单的碳骨架和氮源合成几乎所有氨基酸。对于含硫氨基酸(半胱氨酸、甲硫氨酸、高半胱氨酸),酵母可从培养基中的硫酸盐同化硫。
酵母会按优先顺序吸收麦汁中的氨基酸。自Jones和Pierce(1964)首次描述以来,该顺序除细微变化外基本未变(表7.1),且最近Lekkas等人(2007)对其进行了略微修订;例如,甲硫氨酸的吸收已从B组移至A组。
| 组别A 发酵初期快速吸收 | 组别B 发酵初期缓慢吸收 | 组别C 发酵后期缓慢吸收 | 组别D 发酵期间几乎不吸收 |
|---|---|---|---|
| 天冬氨酸/ 天冬酰胺 | 组氨酸、色氨酸 | 丙氨酸、甘氨酸 | 脯氨酸 |
| 谷氨酸/ 谷氨酰胺 | 酪氨酸、缬氨酸 | (氨) | |
| 赖氨酸 | 苯丙氨酸 | ||
| 精氨酸、丝氨酸、苏氨酸 | |||
| 甲硫氨酸 | |||
| 异亮氨酸、亮氨酸 |
表7.1 麦芽汁酿造酵母对麦芽汁氨基酸的摄取顺序
来源:Jones和Pierce(1964),经Lekkas等人(2007)修订。
蒸馏酵母与氧气
蒸馏酵母可同时利用呼吸作用和发酵代谢途径。酵母倾向于优先使用发酵途径,仅在可发酵糖浓度低且存在氧气时才会启用呼吸途径。因此,以获取生物量为目的的酵母培养属于低糖分供给并伴随大量氧气通入的工业过程。
当可发酵糖浓度较高(超过约1%)时,即便存在氧气,酵母仍倾向于采用发酵途径。据推测,这可能是为了避免细胞因呼吸作用产生的大量ATP而过载。
蒸馏或酿造酵母无法在厌氧条件下无限增殖。经过两到三代后,若缺乏氧气,酵母需要营养补充以维持细胞膜健康。甾醇是酵母细胞膜的必需脂质成分,每次细胞分裂时,膜甾醇会在母细胞和子细胞间稀释。当细胞膜甾醇不足时,细胞要么需要氧气,要么需在麦汁中添加脂质以合成膜甾醇,从而继续形成新细胞。
若细胞膜状态恶化,弱化的细胞会更易受胁迫,导致发酵“停滞”(不完全),并产生不良异味。酵母细胞可从麦汁中摄取甾醇,在内质网合成麦角甾醇,存储于脂滴中,并在需要时转运至质膜。尽管在部分国家(如苏格兰威士忌法规)中,向蒸馏麦汁发酵液直接添加不饱和脂肪酸和甾醇属于违规操作,但麦汁通气(充氧)在所有国家均为合法手段。
总结要点:威士忌发酵用的接种酵母通常在底物(通常为糖蜜)中需氧培养,以获得健康状态,确保后续麦汁发酵顺利进行。其接种量远高于常规,且酵母不重复使用。
蒸馏酵母的商业培养
酿酒用酵母可从众多烘焙与蒸馏酵母制造商处购买,如今市场上有大量专业菌株可供选择,具体取决于目标发酵麦汁的特定发酵需求和感官特性。酵母制造商通过一系列发酵罐对原种培养物进行扩培,在放大过程中逐步增加罐体尺寸,旨在实现细胞快速生长并保持良好的细胞活力与活性(Cheung等人,2012;Nielsen,2010)。
培养基(通常以糖蜜为基质)需补充铵盐和其他缺失的营养物质,酵母在强力通气(充氧)和严格温度控制条件下培养,以获得保留最高活力与活性的产品。糖以约0.5%(w/v)的浓度投喂至发酵液中,以维持酵母的呼吸模式(避免其切换至发酵模式),因为培养目标是积累酵母生物量而非生产乙醇!
随后可通过多种方式收获酵母,如旋转真空过滤(压缩酵母)、收集并以膏状酵母形式出售(便于罐车运输和自动接种)、离心或在部分真空下干燥。通过使用惰性气体(如氮气)包装酵母,可延长产品的保质期。
面包房和蒸馏厂用酵母制造商的目标是在酵母生产过程中尽量减少酒精生成。他们精心控制糖和高浓度氧气的供给,以生产出在用于蒸馏发酵前,无论以何种形式储存都能良好存活的酵母。表7.2展示了在呼吸模式下扩培与在氧气受限的麦汁中扩培时,酵母增殖产量的差异。
| 扩培模式 | 产率系数 | 耗氧量 |
|---|---|---|
| 纯呼吸模式扩培 | 0.54克酵母干固形物/克碳水化合物a | 0.74克氧气/克酵母干固形物 |
| 12°柏拉图麦汁中扩培 | 0.10克酵母干固形物/克碳水化合物 | 0.12克氧气/克酵母干固形物b |
a 假设每升1克酵母干物质约相当于4000万个细胞。
b 相当于每克干酵母每小时10至20毫克氧气(取决于12至20°C范围内的温度)。
表7.2 两种传播模式下氧气消耗的比较
来源:改编自Nielsen(2005, 2010)。
根据所采用的酵母储存方法,通常在酵母接种前需进行液体活化步骤,尤其是当酵母经干燥运输时。每个制造商都会针对所使用的特定菌株详细说明该方法,以确保接种后能快速启动发酵(该过程称为“冒泡”或“活化”)(Stewart,2010)。
若将酿造酵母用作二次发酵酵母(如今已不常见),则必须在从啤酒厂运输至蒸馏厂及后续储存过程中格外小心,以维持细胞活力并避免细菌过度污染。可采用Simpson和Hammond(1989)描述的pH 2.2冷磷酸洗涤法清洗酵母,以降低存在的细菌负荷。然而,酸洗涤无法去除可能存在的任何野生酵母。
发酵需要投入多少酵母?
蒸馏接种率是指压榨酵母重量占所用麦芽及其他谷物重量的百分比。对于麦芽蒸馏厂发酵,典型接种率为1.8%(w/w),而谷物蒸馏厂通常为1.0%(w/w)。因此,麦芽蒸馏厂的接种率会因所用特定酵母和麦汁比重而异。典型情况是每吨麦芽至少使用约18公斤干重的蒸馏酵母(或每升麦汁5克压榨酵母)。目标是使酵母少量生长、发酵快速进行,并实现最大理论酒精产量。若同时使用啤酒酵母作为一半接种物,接种率将增至约22公斤干重/吨。目标是达到约3至4×10⁷个细胞/毫升的接种率。与酿造不同,酵母接种后仅会分裂几次,发酵结束时酵母浓度约为2×10⁸个细胞/毫升。
当啤酒酵母用作二次接种酵母时,其被认为有助于提高麦汁pH值,从而帮助维持酶活性。需氧培养的酵母分泌到麦汁中的丙酮酸会被厌氧培养的啤酒酵母吸收,从而提高pH值,使分解淀粉的淀粉酶能在因麦汁低pH值失活前更长时间地发挥作用。然而,如前所述,目前苏格兰威士忌蒸馏厂很少使用啤酒厂的废酵母,且随着苏格兰啤酒厂(尤其是艾尔啤酒厂)的减少,这种情况将持续下去。
发酵同系物
发酵同系物是发酵和陈酿过程中产生的化合物,包括高级醇、酯类、酸类、醛类、酮类和含硫化合物。它们在赋予威士忌预期风味方面发挥重要作用。酵母及其发酵产物(如杂醇油、脂肪酸及其酯类)对酒精饮料最终香气的影响已被广泛认知(Suomalainen,1971)。其含量因蒸馏产品的不同而有所差异,但这些物质构成了最大且可能最重要的发酵香气化合物群体,是形成产品感官印象的关键因素。
高级醇/杂醇油是酵母在发酵过程中通过氨基酸和碳水化合物的生化反应产生的。酵母生长越旺盛,产生的高级醇越多。它们可通过分解代谢途径(如缬氨酸生成异丁醇)或合成代谢途径(如生成正丙醇)产生。威士忌中最常见的感官活性化合物是异戊醇,其次是异丁醇、旋光性戊醇和丙醇(Suomalainen,1971)。异戊醇是威士忌中的主要杂醇油,占总杂醇油的40%至70%。低浓度时具有愉悦的果香,高浓度时香气则令人不悦。
酯类可赋予烈酒花香和果香,目前已鉴定出90多种不同的发酵酯类。乙酸乙酯是含量最高的主要酯类,其他具有较低香气阈值的酯类也对威士忌风味有重要贡献。乙酸乙酯和许多长链酯类主要由酵母在发酵过程中通过酶促反应形成。乙醇与相应酸类之间形成酯类的化学反应在陈酿过程中也至关重要。图7.12展示了不同途径形成酯类的过程(Suomalainen,1971;Suomalainen和Lehtonen,1979)。酯类是最大的香气化合物群体,主要由脂肪酸乙酯构成。通过相同酸类与杂醇油的酯化反应,酯类的数量进一步增加(Suomalainen,1971)。除乙酸乙酯(果香/溶剂味)外,威士忌中常见的酯类还包括己酸乙酯(苹果/茴香味)、辛酸乙酯(类似苹果香气)、癸酸乙酯(甜、蜡质、果香)、月桂酸乙酯(苹果、微甜、果香)、乙酸异戊酯(香蕉/苹果味)和β-苯乙酸乙酯(玫瑰/蜂蜜味)。
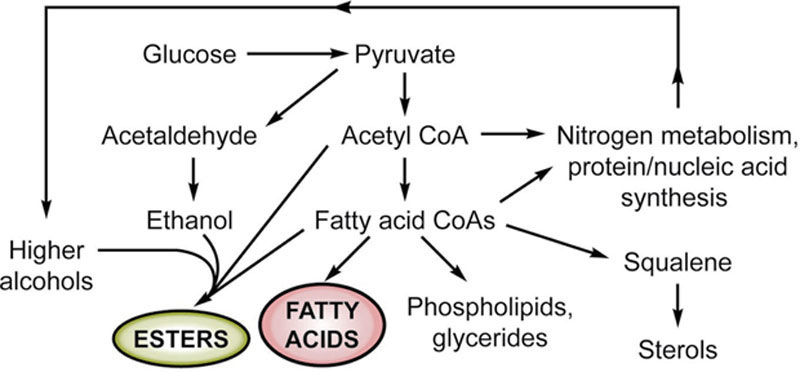
图7.12 酵母生长副产物酯类和脂肪酸的形成。
发酵过程中产生的可影响香气特征的酸类包括乙酸、丙酸、异丁酸、丁酸和异戊酸,脂肪酸包括辛酸、己酸、癸酸和月桂酸。在这些酸类中,异戊酸具有强烈刺鼻的奶酪气味,对烈酒的气味特征贡献最大。
蒸馏厂发酵中的含硫化合物可作为含硫氨基酸生物合成的副产物,或由麦汁中硫酸盐的还原形成。蒸馏器中的铜通过形成不溶性铜盐(如硫化铜)对中和部分含硫化合物和肉类风味起到改善作用(详见第10、14和16章)(Harrison等人,2011)。含硫化合物的气味阈值极低,因此可能对烈酒的最终香气产生显著负面影响。发酵过程中形成的大部分硫化氢(腐蛋气味)会在发酵过程中随二氧化碳释放而排出,但发酵液中残留的硫化氢在蒸馏过程中会形成乙硫醇,随后被氧化为具有极不愉快大蒜味的二乙基二硫醚。一些含硫化合物(如二乙基二硫醚)在橡木桶陈酿过程中会逐年减少,而其他含硫化合物则会保留或在陈酿过程中生成。
发酵过程中形成的羰基化合物是氨基酸合成的副产物。在威士忌中,它们包括乙醛、丙醛、糠醛、2,3-戊二酮、异丁醛、正丁醛、异戊醛、正戊醛和双乙酰。尽管羰基化合物仅占香气成分的一小部分,但其尖锐刺鼻的香气(Salo等人,1972)对气味强度贡献显著。
双乙酰是一种羰基化合物(具有黄油、奶油糖果、爆米花香气),是酵母氮代谢的副产物,也是细菌代谢的产物。蒸馏产品中少量双乙酰可能非常宜人,而大量存在通常被视为严重的风味缺陷。双乙酰的前体在蒸馏初期受热时可迅速转化为双乙酰。该化合物的香气阈值低(1 ppm),且挥发性与乙醇相似,因此一旦存在便难以完全去除。发酵结束时的双乙酰休止期(许多啤酒酿造者采用的方法)可使酵母从麦汁中去除过量双乙酰。行业中有一条通用原则:“蒸馏劣质发酵液永远无法产出优质威士忌”。以优质发酵液为起点始终至关重要!
酚类在威士忌中含量较少,且这些化合物大多源于原料,而非发酵副产物。
尽管上述所有香气化合物均可在发酵过程中形成,但在最终蒸馏饮品中,香气化合物的组成会因所使用的蒸馏技术(如是否存在酵母)和后续陈酿方式而有所不同(Suomalainen和Lehtonen,1979)。还需注意的是,主发酵期间细菌的存在以及发酵末期乳酸菌的快速生长将影响最终烈酒的风味(和pH值)。感官分析在第13章详细讨论。然而,出于味觉评估员培训目的,威士忌风味轮盘及配套描述表收录于附录A和B(第399–400页),其中可找到威士忌描述词和参考化合物浓度。
麦汁发酵
啤酒麦芽汁发酵与蒸馏麦芽汁发酵存在许多相似之处,但也有显著差异。蒸馏麦芽汁在发酵前不像啤酒麦芽汁那样经过煮沸灭菌。因此,蒸馏麦芽汁中的淀粉酶不会失活,它们会在发酵过程中继续将较大的碳水化合物分子水解为酵母可代谢的较小单位(Bathgate和Bringhurst,2011)。因此,啤酒发酵总会残留一些不可发酵的糊精(这些糊精用于赋予啤酒口感和酒体),而蒸馏厂的发酵会将麦芽汁发酵至更低的最终比重,并产生更高的酒精浓度。
所使用的发酵容器(发酵槽)在尺寸、整体几何形状和构造上差异很大。麦芽蒸馏厂的发酵罐容量通常小得多(可达30,000升),传统的木质发酵容器也并不罕见。谷物蒸馏厂的发酵罐容量通常大得多(250,000升或更大),具备温度控制、原位清洗和搅拌能力,并且由不锈钢建造。
典型苏格兰威士忌麦芽汁的浓度比重范围为1060至1070(15至17°柏拉图),产生约7.5%(w/v)的酒精,而谷物麦芽汁的浓度更高(约19至20°柏拉图)。随着人们对高比重发酵在酵母活力和醪液处理方面需求的深入理解(Stewart,2010),更高比重的麦芽汁发酵正变得越来越普遍,目标是达到更高的酒精水平。高比重麦芽汁对工厂的整体产能有积极影响,但最终麦芽汁中产生的更高酒精浓度可能导致蒸馏问题(详见第9章)。蒸馏厂发酵的最终比重会降至1000以下,被称为“低于度数”。因此,发酵结束时的典型读数为2.5度以下(或比重计刻度为975)。
发酵会产生大量热量。啤酒发酵过程中会仔细监控冷却,以维持酵母活力,确保酵母健康以便重复使用,并保持啤酒的风味特征。与啤酒发酵相比,蒸馏厂发酵通常不太强调温度控制。麦芽汁在环境温度(约20°C)下接种。必要时可提供冷却,例如使用外部冷却器,以将发酵温度维持在酵母仍能繁殖和发酵的水平。温度会升高到28至32°C,具体取决于当地环境温度和起始比重。理想的发酵温度是较高温度带来的发酵速度与过高温度对酵母活力的负面影响之间的折中。有许多商业酵母的耐温性可达34°C及以上,可供使用。超过38°C时,大多数饮料蒸馏酵母无法繁殖或发酵。发酵在前30小时内快速进行,比重降至约1000;起始pH值5.2至5.3降至约4.2,后期可能因细菌代谢而升高。
由于麦芽汁未经过煮沸,预计会有一些细菌生长。然而,63至65°C的麦芽汁糖化温度会大幅降低细菌负荷。发酵后期的细菌污染可能对风味同系物产生积极贡献(见第8章)。然而,发酵早期的严重细菌感染是不可取的,尤其是如果糖分被细菌用于生长而不是被酵母用于生产酒精,会导致烈酒产量损失。在蒸馏厂麦芽汁的发酵过程中,碳水化合物组成会持续变化。
图7.13展示了典型蒸馏厂发酵的进程,在最初的24小时内酵母活跃生长(对数期)。发酵初期温度升高,酵母持续吸收糖分,直到所有可发酵物质被利用。氮与糖分一起被利用,但仅在酵母活跃生长阶段。活跃生长阶段结束后,氮不再被吸收,但酒精仍继续产生。在麦芽和谷物蒸馏厂的发酵过程中,淀粉酶(α-淀粉酶、β-淀粉酶和极限糊精酶,均来自麦芽大麦)的活性持续存在,淀粉在整个发酵过程中随着水解的进行转化为可发酵糖。由于麦芽汁未被煮沸,酶活性不会像啤酒发酵那样失活。如果细菌发酵是过程的一部分,麦芽蒸馏厂的发酵可在48小时或更长时间内完成。然而,为了适应必要的蒸馏厂工作日程,谷物蒸馏厂倾向于整周运行,因此发酵日程更为统一。蒸馏发酵过程中的酶活性(称为二次转化)可占烈酒产量的15%。在所有麦芽麦芽汁中,氨基酸并不受限,但在谷物麦芽汁中可能成为限制因素。
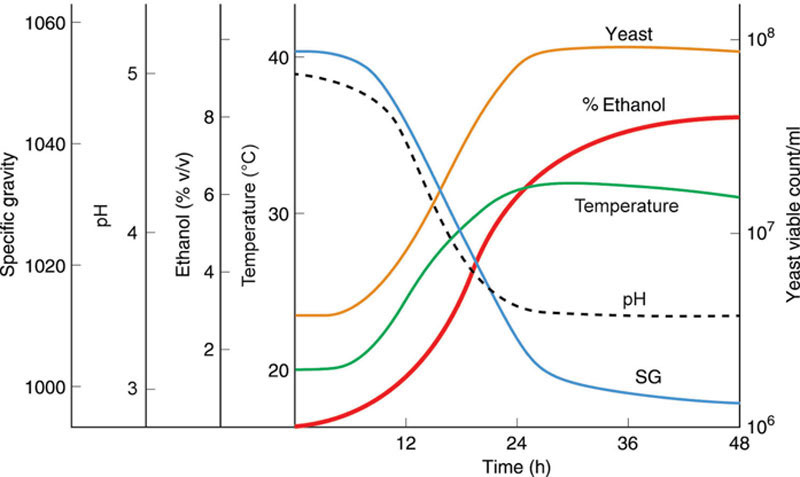
蒸馏麦芽汁中的糖分吸收
酵母从麦芽汁中摄取可发酵糖,以产生乙醇、二氧化碳、甘油和各种风味同系物。这些风味代谢物排泄至发酵液(发酵后的麦芽汁)中,赋予烈酒大部分(而非全部)独特风味。啤酒和蒸馏麦芽汁中的主要可发酵糖为葡萄糖、麦芽糖和麦芽三糖(有时含少量果糖和蔗糖)。此外,麦芽汁还含有糊精,包括麦芽四糖(G4)和更大的糊精。对于啤酒生产用麦芽汁,啤酒酵母按特定顺序摄取糖分:葡萄糖、果糖(若存在)、麦芽糖和麦芽三糖,而啤酒酵母不摄取糊精。威士忌发酵中蒸馏麦芽汁的糖分摄取模式更为多变和复杂(图7.14)。如前所述,蒸馏麦芽汁未经过煮沸(不同于煮沸的啤酒麦芽汁),因此含有活性酶(尤其是淀粉酶)以及来自原料(大麦芽和未发芽谷物)和蒸馏设备(糖化混合器和发酵罐)的污染微生物。因此,在发酵过程中,可发酵糖持续从糊精和淀粉中生成,并被酵母摄取,少量被污染细菌(如乳杆菌等菌种)摄取。这意味着蒸馏发酵中的糖分摄取模式比啤酒麦芽汁发酵更具可变性、复杂性和动态性。与啤酒发酵相比,蒸馏发酵中的糖分摄取特征尚未被充分表征,这是需要进一步关注的领域。
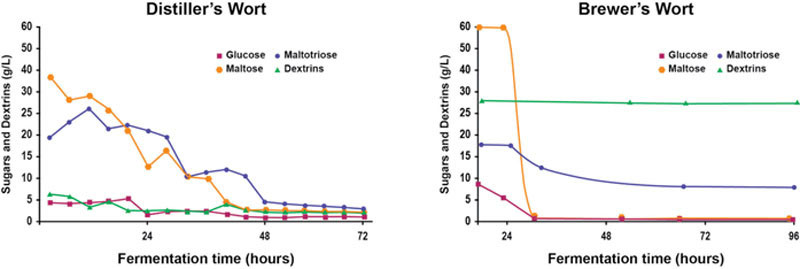
典型麦芽蒸馏麦芽汁在接种时的大致糖分组成如下:蔗糖2%、果糖1%、葡萄糖10%、麦芽糖50%、麦芽三糖15%、麦芽四糖10%和糊精10%。由于淀粉酶活性持续将糊精分解为更小分子,麦芽汁中的糊精水平在发酵过程中持续下降。存在的糖分并非同时被利用:葡萄糖可被酵母直接利用,且由于所有所需的转运系统均已存在,会被酵母首先摄取。麦芽糖和麦芽三糖含量最高,但最初不被酵母利用——它们的转运系统需要诱导,且仅在特定糖分存在时(且直至葡萄糖浓度下降后)才会合成相关酶。在发酵过程中,由于酶的活性,较小的可发酵糖持续从较大的糊精中生成。此外,葡萄糖还可从麦芽汁中已存在的麦芽糖和麦芽三糖(作为糖化过程中产生的可发酵糖之一)转化而来。因此,蒸馏发酵中的糖分摄取模式与啤酒麦芽汁发酵截然不同——后者的糖分摄取顺序有序且一致(Stewart和Russell,2009)。
总结
蒸馏酵母具有许多与酿造酵母菌株相似的特征。然而,这两种类型的酵母之间也存在许多差异。对蒸馏培养物的管理方式有直接影响的最重要区别在于,此类培养物不进行回收利用,仅使用一次,而酿造酵母培养物则会在多个独立发酵过程中循环使用。蒸馏酵母培养物通常由独立的酵母供应商扩培,而酿造酵母培养物通常在啤酒厂现场培养或由集团内的其他啤酒厂供应。此外,与酿造麦芽汁不同,蒸馏麦芽汁不经过煮沸;因此,它仍然含有淀粉酶和蛋白酶活性,以及存活的细菌和野生酵母。
蒸馏酵母进行麦芽汁发酵的目标是持续将麦芽汁成分(主要是糖类和含氮物质)代谢为酒精和众多其他发酵产物,以便在蒸馏前生产发酵麦芽汁,并最终生产出具有令人满意风味和品质的威士忌。
参考文献
- Bathgate GN, Bringhurst TA. 致编辑的信:关于麦芽酶对淀粉结构和降解的知识更新(DP/DU和极限糊精酶)。《酿造学会杂志》. 2011;117:33–38.
- Cheung AWY, Brosnan JM, Phister T, Smart KA. 干燥、膏状和饼状供应形式对三种酿酒酵母蒸馏菌株遗传变异和乙醇耐受性的影响。《酿造学会杂志》. 2012;118:152–162.
- Goffeau A, Barrell BG, Bussey H, Davis RW, Dujon B, Feldmann H, Galibert F, Hoheisel JD, Jacq C, Johnston M, Louis EJ, Mewes HW, Murakami Y, Philippsen P, Tettelin H, Oliver SG. 拥有6000个基因的生命。《科学》. 1996;274:563–567.
- Harrison B, Fagnen O, Jack F, Brosnan J. 麦芽威士忌壶式蒸馏器不同部位的铜对新酒成分和香气的影响。《酿造学会杂志》. 2011;117:106–112.
- Hittinger CT. 酵母属的多样性与进化:一个萌芽的模式属。《遗传学趋势》. 2013;29(5):309–317.
- Jones M, Pierce J. 酵母从麦芽汁中吸收氨基酸的研究。《酿造学会杂志》. 1964;70:307–315.
- Lekkas C, Stewart GG, Hill AE, Taidi B, Hodgson J. 阐明麦芽汁含氮成分在酵母发酵中的作用。《酿造学会杂志》. 2007;113:183–191.
- Lekkas C, Hill AE, Stewart GG. 制麦和糖化过程中从麦芽大麦中提取游离氨基酸氮。《美国酿造化学家协会杂志》. 2014;72:6–11.
- Naumov GI, Lee C-F, Naumova ES. 台湾地区酵母属的分子遗传多样性:树生酵母、酿酒酵母和库德里阿兹威酵母。《安东·范·列文虎克》. 2013;103:217–228.
- Nielsen O. 酵母扩培过程的控制:如何优化氧气供应并最小化应激。《美洲酿造大师协会技术季刊》. 2005;42(2):101–106.
- Nielsen O. 酵母扩培过程的现状及再发酵扩培的若干方面。《啤酒》. 2010;35:71–74.
- Noguchi Y, Urasaki K, Yomo H, Yonezawa T. 酿造酵母性能对新酒特征的影响。收录于:Bryce JH, Piggott JR, Stewart GG 编. 《蒸馏酒:生产、技术与创新》. 英国诺丁汉:诺丁汉大学出版社; 2008:109–122.
- Salo P, Nykänen L, Suomalainen H. 模拟威士忌的人工饮料中挥发性香气成分的气味阈值和相对强度。《食品科学杂志》. 1972;37(3):394–398.
- Simpson WJ, Hammond JRM. 酿造酵母对酸洗涤的响应。《酿造学会杂志》. 1989;96:347–354.
- Suomalainen H. 酵母及其对酒精饮料风味的影响。《酿造学会杂志》. 1971;77:164–177.
- Suomalainen H, Lehtonen M. 酵母产生香气化合物的研究。《酿造学会杂志》. 1979;85:149–156.
- Stewart GG. 高比重酿造与蒸馏:过去的经验与未来的前景。《美国酿造化学家协会杂志》. 2010;68:1–9.
- Stewart GG, Russell I. 《酿造科学与技术导论》第三系列:酿造酵母(第二版). 伦敦:酿造与蒸馏学会, 2009.
- Stewart GG, Hill AE, Russell I. 125周年回顾:酿造与蒸馏酵母菌株的发展。《酿造学会杂志》. 2013;119:202–220.
- Van Vuuren HJJ, Jacobs CJ. 葡萄酒行业中的杀伤酵母:综述。《美国葡萄栽培与酿酒杂志》. 1992;43:119–128.
- Walther A, Hesselbart A, Wendland J. 世界上首个纯培养拉格酵母——卡尔斯伯酵母的基因组序列。《G3:基因、基因组、遗传学》. doi: 10.1534/g3.113.010090.
- Wong ED, Karra K, Hitz BC, Eurie L, Hong EL, Cherry JM. YeastGenome应用:触手可及的酵母基因组数据库。《数据库(牛津)》. DOI: 10.1093/database/bat004.
回到目录